Проверка концентрации теплоносителя системы отопления
| Раствор | Температура замерзания | Плотность при 20˚С | Раствор | Температура замерзания | Плотность при 20˚С |
| Пропиленгликоль 30% | -13˚С | 1,023 | Этиленгликоль 30% | -15˚С | 1,038 |
| Пропиленгликоль 35% | -20˚С | 1,028 | Этиленгликоль 35% | -20˚С | 1,045 |
| Пропиленгликоль 40% | -25˚С | 1,032 | Этиленгликоль 40% | -25˚С | 1,052 |
| Пропиленгликоль 45% | -30˚С | 1,035 | Этиленгликоль 45% | -30˚С | 1,058 |
| Пропиленгликоль 50% | -35˚С | 1,038 | Этиленгликоль 50% | -35˚С | 1,064 |
| Пропиленгликоль 55% | -45˚С | 1,040 | Этиленгликоль 55% | -43˚С | 1,071 |
| Пропиленгликоль 60% | -55˚С | 1,042 | Этиленгликоль 60% | -50˚С | 1,077 |
| Пропиленгликоль 65% | -60˚С | 1,043 | Этиленгликоль 65% | -60˚С | 1,083 |
| Пропиленгликоль 70% | -65˚С | 1,044 | Этиленгликоль 70% | -70˚С | 1,088 |
Из-за склонности растворов гликолей к переохлаждению фактическая температура замерзания может отличаться в пределах 2˚С.
Теплоноситель DIXIS-30 (Диксис-30) предназначен для использования в системах отопления, холодоснабжения для бытовых и промышленных зданий, теплоноситель исключает возможность «размораживания» систем при низких температурах, что недопускает разрыв трубопроводов, теплообменников, калориферов и т.д.
Теплоноситель DIXIS-30 — это готовая к использованию прозрачная однородная жидкость рыжего цвета без механических примесей.
Теплоноситель DIXIS-30 — это готовый раствор на основе этиленгликоля, содержащий сбалансированный пакет присадок, в который входят: антикоррозионные, антипенные, антиокислительные и термостабилизирующие, а также присадки, повышающие инертность к уплотнительным материалам.
Технические характеристики
Температура начала кристаллизации: минус 30°C.
Плотность при 20°C: 1,070 г/см3.
Температура кипения при атмосферном давлении: не ниже 106°C.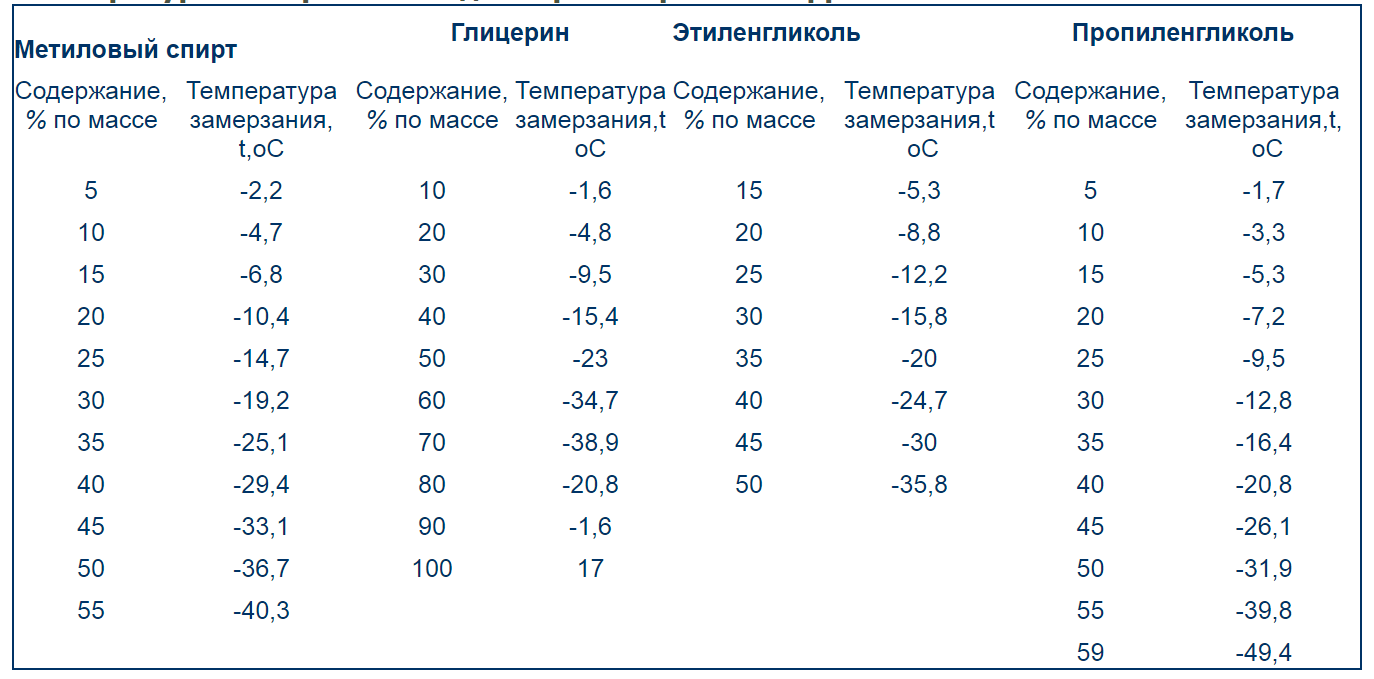
Содержание этиленгликоля: 45,34%
Теплоноситель DIXIS-65 (Диксис-65) предназначен для использования в системах отопления, холодоснабжения для бытовых и промышленных зданий, теплоноситель исключает возможность «размораживания» систем при низких температурах, что недопускает разрыв трубопроводов, теплообменников, калориферов и т.д.
Теплоноситель DIXIS-65 — это готовая к использованию прозрачная однородная жидкость желто-зеленого цвета без механических примесей. Его можно использовать в регионах где температура не превышает -60°C или в разбавленном виде в районах с умеренными температурными показаниями.
Теплоноситель DIXIS-65 — это раствор моноэтиленгликоля, содержащий сбалансированный пакет присадок, в который входят: антикоррозионные, антипенные, антиокислительные и термостабилизирующие присадки, а также присадки, повышающие инертность к уплотнительным материалам.
Технические характеристики
Температура начала кристаллизации: минус 65°C.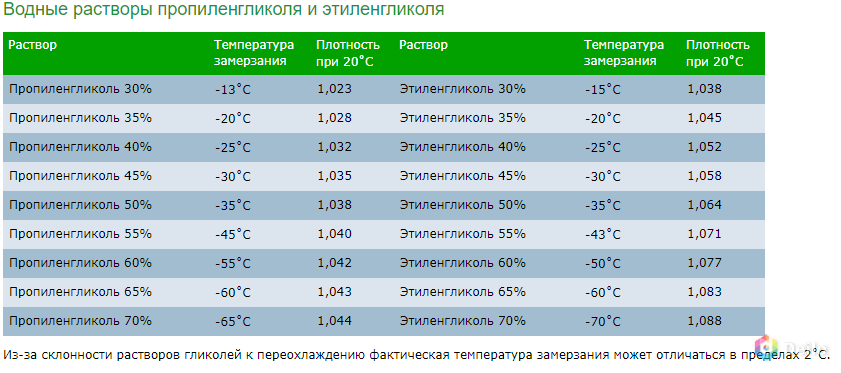
Плотность при 20°C: 1,091 г/см3.
Температура кипения при атмосферном давлении: не ниже 111°C.
Содержание этиленгликоля: 63,0%
Безопасный антифриз DIXIS TOP (Диксис ТОП) предназначен для использования в качестве рабочей жидкости в теплообменных объектов пищевой, фармацевтической, парфюмерной и других отраслей промышленности, а также в системах отопления и кондиционирования, с целью исключения «размораживания» систем при отрицательных температурах и для защиты оборудования. Специальные присадки надежно защищают от возникновения коррозии, образования накипи, а так же развития микроорганизмов.
DIXIS TOP — готовый к использованию антифриз с температурой начала кристаллизации минус 30°C. Допускается разбавление водой в соотношении 1:1 для получения антифриза с температурой начала кристаллизации минус 10°C. Идеально подходит для использования с электрическими или газовыми настенными котлами, антифриз позволит избежать метные перегревы.
Теплоноситель DIXIS TOP — это водный раствор пропиленгликоля, содержащий сбалансированный пакет присадок. Выгодно отличается по токсикологическим свойствам от традиционных антифризов технического назначения на основе моноэтиленгликоля
Технические характеристики
Температура начала кристаллизации: минус 30°C.
Температура замерзания: минус 40°C.
Плотность при 20°C: 1,045 г/см3.
Температура кипения при атмосферном давлении: не ниже 105°C.
Содержание пропиленгликоля: 45,05%
АНТИФРИЗЫ на основе этилен- и пропиленгликолей и ВОДА. Температуры замерзания. Вязкости. Плотности. Теплоемкости. Антифризы это — жидкости, применяемые для охлаждения двигателей внутреннего сгорания, радиоэлектронной аппаратуры, промышленных теплообменников и других установок, работающих при температурах ниже 0°С. Наиболее распространены антифризы на основе водных растворов этиленгликоля и пропиленгликоля (см.ниже). Однако такие растворы вызывают значительную коррозию металлов, поэтому в них добавляют ингибиторы коррозии — Na СВОЙСТВА АНТИФРИЗОВ НА ОСНОВЕ ВОДНЫХ РАСТВОРОВ СОЛЕЙ (справочная таблица для интереса, такие антифризы практически вышли из употребления)
ЭТИЛЕНГЛИКОЛЬ (1,2-этандиол) НОСН2СН2ОН, бесцветная вязкая гигроскопичная жидкость без запаха, сладковатого вкуса; температура плавления -12,7 °С, температура кипения 197,6 °С. ПРОПИЛЕНГЛИКОЛИ (пропандиолы) С3Н6 (ОН)2 Известны 2 изомера: 1,2-П. СН3СНОНСН2ОН (1,2-пропандиол) и 1,3-П. СН2ОНСН2СН2ОН. Пропиленгликоли бесцветные вязкие гигроскопичные жидкости сладковатого вкуса, без запаха. Для 1,2-П. температура плавления -60 °С, температура кипения 189 °С. Для 1,3-П. температура плавления -32°С, температура кипения 213,5°С. 1,2-П. растворим в воде, диэтиловом эфире, одноатомных спиртах, карбоновых кислотах, альдегидах, аминах, ацетоне, этиленгликоле, ограниченно растворим в бензоле. При смешении его с водой или аминами резко снижается температура замерзания растворов. Токсичность 1,2-П. (ЛД50 34,6 мг/кг, крысы) ниже, чем у этиленгликоля. Уровни безопасности для усредненных сроков хранения (биохимической активности) продуктов при добавлении в них 0,2% массового количества хладоносителя приведены ниже.
Температура замерзания водных растворов этиленгликоля и пропиленгликоля
Физические свойства водного раствора этиленгликоля.
Физические свойства водного раствора пропиленгликоля ( 1,2-Пропиленгликоль C3H6(OH)2)
Физические свойства воды.
|
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Свойства рабочих сред / / Антифризы. / / Пропиленгликоль — Вода. Плотность, температура замерзания, теплоемкость Cp, теплопроводность, водного раствора пропиленгликоля = 1,2 пропандиол =1,2-Propylenglycol- антифриза и теплоносителя для систем отпления и центрального кондиционирования.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Свойства рабочих сред / / Антифризы. / / Как разбавлять антифриз для систем отопления и центрального кондиционирования. Температура замерзания водных растворов этиленгликоля и пропиленгликоля. Концентрация по массе.
| ||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу.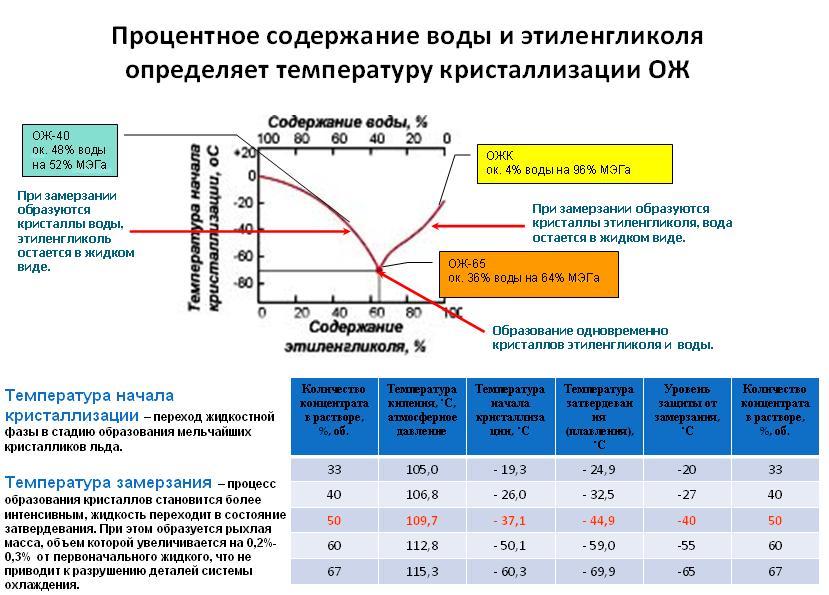 | |||||||||||||||||||||||||||||||||||
| TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||||||||||||||||||||||
Теплоноситель — Пропиленгликоль (-30°С)
Цена: $4
Пропиленгликоль: свойства и характеристики
Пропиленгликоль — бесцветная густая жидкость со слабым характерным запахом, смешивается с водой и спиртом, обладает гигроскопическими свойствами. Его температура кипения при атмосферном давлении 187,4 °C, температура замерзания –60 °C, плотность при 20°C — 1, 037 г/см3. ЛД50 – 34,6 мг/кг. Температура самовоспламенения 421°C. Водные растворы пропиленгликоля до 60°C не горючи. На основе пропиленгликоля производятся наиболее безопасные по экологическим и токсикологическим свойствам бытовые теплоносители. Пропиленгликоль разрешен к применению во всех странах для использования в качестве пищевой добавки (Е 1520). Благодаря низкой токсичности пропиленгликоля попадание небольшого (до 0,25%) количества теплоносителя на его основе в результате случайных протечек в пищевой продукт не вызывает порчи последнего. Коррозионная активность пропиленгликоля ниже, чем у большинства известных водных растворов солей и спиртов, что позволяет предъявлять невысокие требования к сортности стали для оборудования и снизить стоимость используемого оборудования. Зависимость температуры замерзания теплоносителей от концентрации в них пропиленгликоля(Табл.1):
Температура самовоспламенения 421°C. Водные растворы пропиленгликоля до 60°C не горючи. На основе пропиленгликоля производятся наиболее безопасные по экологическим и токсикологическим свойствам бытовые теплоносители. Пропиленгликоль разрешен к применению во всех странах для использования в качестве пищевой добавки (Е 1520). Благодаря низкой токсичности пропиленгликоля попадание небольшого (до 0,25%) количества теплоносителя на его основе в результате случайных протечек в пищевой продукт не вызывает порчи последнего. Коррозионная активность пропиленгликоля ниже, чем у большинства известных водных растворов солей и спиртов, что позволяет предъявлять невысокие требования к сортности стали для оборудования и снизить стоимость используемого оборудования. Зависимость температуры замерзания теплоносителей от концентрации в них пропиленгликоля(Табл.1):
Табл. 1
|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
Содержание, % масс. |
54 |
48 |
39 |
25 |
15 |
1 |
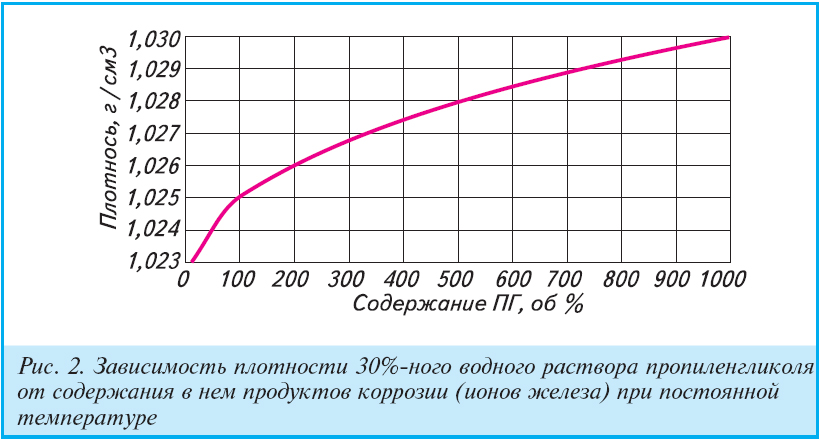
В домашних условиях можно определить температуру замерзания tзамерзания °Сэксплуатируемого теплоносителя по плотности. Зависимость плотности от температуры замерзания для водных растворов пропиленгликоля приведены в таблице 2.
Зависимость плотности от температуры начала кристаллообразования пропиленгликоля:
Табл. 2
|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
Плотность, кг/м. |
1040 |
1037 |
1031 |
1019 |
1010 |
999,3 |
Теплоносители на основе пропиленгликоля
Низкозамерзающие теплоносители на основе водного раствора пропиленгликоля широко используются в различных отраслях промышленности в качестве теплоносителей (антифризов), в том числе в системах отопления, вентиляции, кондиционирования жилых домов и общественных зданий, в системах охлаждения пищевых производств, а также в другом теплообменном оборудовании в интервале температур от минус 40°С до плюс 108°С. В частности, на основе пропиленгликоля производится теплоноситель, применяемый для систем отопления и кондиционирования коттеджей и зданий. При аварийном разливе теплоносителя его достаточно собрать мокрой тряпкой. В то же время, при проливе этиленгликольсодержащих теплоносителей рекомендуется менять или плитку, или деревянный пол и утеплитель, впитавшие ядовитый этиленгликоль.
В то же время, при проливе этиленгликольсодержащих теплоносителей рекомендуется менять или плитку, или деревянный пол и утеплитель, впитавшие ядовитый этиленгликоль.
Теплоноситель — Пропиленгликоль (-60°С)
Цена: $6
Пропиленгликоль: свойства и характеристики
Пропиленгликоль — бесцветная густая жидкость со слабым характерным запахом, смешивается с водой и спиртом, обладает гигроскопическими свойствами. Его температура кипения при атмосферном давлении 187,4 °C, температура замерзания –60 °C, плотность при 20°C — 1, 037 г/см3. ЛД50 – 34,6 мг/кг. Температура самовоспламенения 421°C. Водные растворы пропиленгликоля до 60°C не горючи. На основе пропиленгликоля производятся наиболее безопасные по экологическим и токсикологическим свойствам бытовые теплоносители. Пропиленгликоль разрешен к применению во всех странах для использования в качестве пищевой добавки (Е 1520). Благодаря низкой токсичности пропиленгликоля попадание небольшого (до 0,25%) количества теплоносителя на его основе в результате случайных протечек в пищевой продукт не вызывает порчи последнего. Коррозионная активность пропиленгликоля ниже, чем у большинства известных водных растворов солей и спиртов, что позволяет предъявлять невысокие требования к сортности стали для оборудования и снизить стоимость используемого оборудования. Зависимость температуры замерзания теплоносителей от концентрации в них пропиленгликоля(Табл.1):
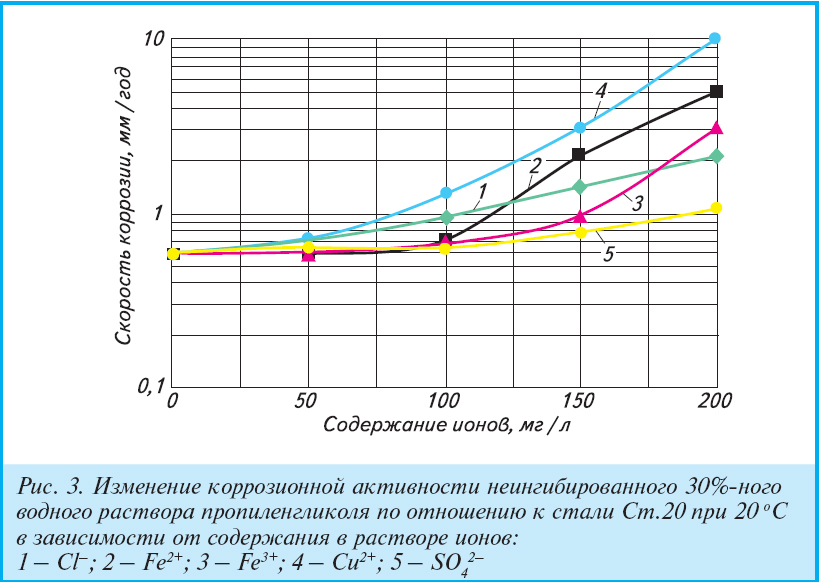
Коррозионная активность пропиленгликоля ниже, чем у большинства известных водных растворов солей и спиртов, что позволяет предъявлять невысокие требования к сортности стали для оборудования и снизить стоимость используемого оборудования. Зависимость температуры замерзания теплоносителей от концентрации в них пропиленгликоля(Табл.1):
Табл. 1
|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
Содержание, % масс. |
54 |
48 |
39 |
25 |
15 |
1 |
В домашних условиях можно определить температуру замерзания tзамерзания °Сэксплуатируемого теплоносителя по плотности. Зависимость плотности от температуры замерзания для водных растворов пропиленгликоля приведены в таблице 2.
Зависимость плотности от температуры замерзания для водных растворов пропиленгликоля приведены в таблице 2.
Зависимость плотности от температуры начала кристаллообразования пропиленгликоля:
Табл. 2
|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
Плотность, кг/м.куб. |
1040 |
1037 |
1031 |
1019 |
1010 |
999,3 |
Теплоносители на основе пропиленгликоля
Низкозамерзающие теплоносители на основе водного раствора пропиленгликоля широко используются в различных отраслях промышленности в качестве теплоносителей (антифризов), в том числе в системах отопления, вентиляции, кондиционирования жилых домов и общественных зданий, в системах охлаждения пищевых производств, а также в другом теплообменном оборудовании в интервале температур от минус 40°С до плюс 108°С. В частности, на основе пропиленгликоля производится теплоноситель, применяемый для систем отопления и кондиционирования коттеджей и зданий. При аварийном разливе теплоносителя его достаточно собрать мокрой тряпкой. В то же время, при проливе этиленгликольсодержащих теплоносителей рекомендуется менять или плитку, или деревянный пол и утеплитель, впитавшие ядовитый этиленгликоль.
В частности, на основе пропиленгликоля производится теплоноситель, применяемый для систем отопления и кондиционирования коттеджей и зданий. При аварийном разливе теплоносителя его достаточно собрать мокрой тряпкой. В то же время, при проливе этиленгликольсодержащих теплоносителей рекомендуется менять или плитку, или деревянный пол и утеплитель, впитавшие ядовитый этиленгликоль.
Теплоносители на основе пропиленгликоля
Для многих приложений теплопередачи необходимо использовать теплоноситель с более низкой температурой замерзания, чем вода. Самый распространенный антифриз — этиленгликоль — нельзя использовать там, где есть вероятность утечки в питьевую воду или системы пищевой промышленности.
В системах пищевой промышленности обычным теплоносителем является пропиленгликоль.
Точки замерзания водных растворов на основе пропиленгликоля
Точка замерзания водных растворов на основе пропиленгликоля при различных температурах:
| Точка замерзания | ||||||||
| Раствор пропиленгликоля (%) | по массе | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| по объему | 0 | 10 | 19 | 29 | 40 | 50 | 60 | |
| Температура | o F | 32 | 26 | 18 | 7 | -8 | -29 | -55 |
| o C | 0 | -3 | -8 | -14 | -22 | -34 | -48 | |
Из-за образования слякоти — раствор пропиленгликоля и воды не следует использовать вблизи точек замерзания.
Удельный вес растворов пропиленгликоля
Удельный вес растворов пропиленгликоля:
| Удельный вес — SG — | ||||||||
| Раствор пропиленгликоля (%) Масса | 22 по массе0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| по объему | 0 | 10 | 20 | 29 | 40 | 50 | 60 | |
| Удельный вес — SG — 1) | 1.000 | 1.008 | 1.017 | 1.026 | 1.034 | 1.041 | 1.046 | |
1) Удельный вес на основе растворов пропиленгликоля с температурой 60 o F.
Плотность воды с пропиленгликолем Растворы
Точки кипения растворов пропиленгликоля
Точки кипения растворов пропиленгликоля:
| Точка кипения | ||||||||
| Раствор пропиленгликоля (%) | по массе | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| по объему | 0 | 10 | 20 | 29 | 40 | 50 | 60 | |
| Температура ( o F) | 2 12 | 212 | 213 | 216 | 219 | 222 | 225 | |
Удельная теплоемкость растворов пропиленгликоля
Удельная теплоемкость растворов пропиленгликоля:
- 1 фунт / м3 o F) = 4186.
 8 Дж / (кг · К) = 1 ккал / (кг o C)
8 Дж / (кг · К) = 1 ккал / (кг o C)
Пропиленгликоль Изображения, стоковые фотографии и векторные изображения
В настоящее время вы используете более старую версию браузера, и ваши возможности могут быть неоптимальными. Пожалуйста, подумайте об обновлении. Учить больше. ImagesImages homeCurated collectionsPhotosVectorsOffset ImagesCategoriesAbstractAnimals / WildlifeThe ArtsBackgrounds / TexturesBeauty / FashionBuildings / LandmarksBusiness / FinanceCelebritiesEditorialEducationFood и DrinkHealthcare / MedicalHolidaysIllustrations / Clip-ArtIndustrialInteriorsMiscellaneousNatureObjectsParks / OutdoorPeopleReligionScienceSigns / SymbolsSports / RecreationTechnologyTransportationVectorsVintageAll categoriesFootageFootage homeCurated collectionsShutterstock SelectShutterstock ElementsCategoriesAnimals / WildlifeBuildings / LandmarksBackgrounds / TexturesBusiness / FinanceEducationFood и DrinkHealth CareHolidaysObjectsIndustrialArtNaturePeopleReligionScienceTechnologySigns / SymbolsSports / RecreationTransportationEditorialAll categoriesEditorialEditorial главнаяРазвлеченияНовостиРоялтиСпортМузыкаМузыка домойПремиумBeatИнструментыShutterstock EditorМобильные приложенияПлагиныИзменение размера изображенияКонвертер файловСоздатель коллажейЦветовые схемыБлог Главная страница блогаДизайнВидеоКонтроллерНовостиPremiumBeat blogEnterprisePric ing
Войти
Зарегистрироваться
Меню
ФильтрыОчистить всеВсе изображения- Все изображения
- Фото
- Векторы
- Иллюстрации
- Редакционный
- Музыка Видеоматериалы
- Для описания взаимосвязи между концентрацией растворенного вещества и физическими свойствами раствора.
- Понимать, что общее количество нелетучих частиц растворенного вещества определяет снижение давления пара, повышение температуры кипения и снижение температуры замерзания раствора по сравнению с чистым растворителем.
- Ответ
100.04 ° C, или 100 ° C с точностью до трех значащих цифр. (Напомним, что 1 моль \ (\ ce {NaCl} \) дает 2 моля растворенных частиц. Небольшое повышение температуры означает, что добавление соли в воду, используемую для приготовления макаронных изделий, практически не влияет на время приготовления.)
- \ (T_f \) — точка замерзания раствора.
30 propylene Поиск по изображению от
Наиболее актуальные
Свежий контент
Тип изображенияВсе изображения
Фото
Векторы
Иллюстрации
ОриентацияВсе ориентации
Горизонтально
Вертикально
Цвет
13.8: Понижение температуры замерзания и повышение температуры кипения растворов неэлектролитов
Цели обучения
Многие физические свойства растворов значительно отличаются от свойств чистых веществ, рассмотренных в предыдущих главах, и эти различия имеют важные последствия.Например, ограниченный диапазон температур жидкой воды (0–100 ° C) сильно ограничивает ее использование. Водные растворы имеют более низкую температуру замерзания и более высокую температуру кипения, чем чистая вода. Вероятно, одно из самых известных применений этого явления — добавление этиленгликоля («антифриз») к воде в автомобильном радиаторе. Это растворенное вещество снижает точку замерзания воды, предотвращая растрескивание двигателя в очень холодную погоду из-за расширения чистой воды при замерзании.Антифриз также позволяет системе охлаждения работать при температурах выше 100 ° C без создания давления, достаточного для взрыва.
Изменения точки замерзания и кипения раствора зависят в первую очередь от количества присутствующих частиц растворенного вещества, а не от типа частиц. Такие свойства решений называются коллигативными свойствами (от латинского colligatus, что означает «связанные вместе», как в количестве). Как мы увидим, давление пара и осмотическое давление растворов также являются коллигативными свойствами.
Когда мы определяем количество частиц в растворе, важно помнить, что не все растворы с одинаковой молярностью содержат одинаковую концентрацию растворенных частиц. Рассмотрим, например, 0,01 М водные растворы сахарозы, \ (NaCl \) и \ (\ ce {CaCl_2} \). Поскольку сахароза растворяется с образованием раствора нейтральных молекул, концентрация растворенных частиц в 0,01 М растворе сахарозы составляет 0,01 М. Напротив, как \ (\ ce {NaCl} \), так и \ (\ ce {CaCl_2} \) являются ионные соединения, которые диссоциируют в воде с образованием сольватированных ионов.{3 +} \)), или в растворах с менее полярными растворителями диссоциация с образованием отдельных ионов часто бывает неполной. Сумма концентраций растворенных частиц растворенного вещества определяет физические свойства раствора. Поэтому в следующем обсуждении мы должны твердо помнить о химической природе растворенного вещества.
Повышение температуры кипения
Напомним, что нормальная точка кипения вещества — это температура, при которой давление пара составляет 1 атм. Если нелетучее растворенное вещество снижает давление пара растворителя, оно также должно влиять на точку кипения.Поскольку давление пара раствора при данной температуре меньше давления пара чистого растворителя, для достижения давления пара 1 атм для раствора требуется более высокая температура, чем нормальная точка кипения растворителя. Таким образом, температура кипения раствора всегда выше, чем у чистого растворителя. Мы можем понять, почему это должно быть правдой, сравнив диаграмму состояния водного раствора с диаграммой состояния чистой воды (рисунок \ (\ PageIndex {1} \)). Давление паров раствора меньше, чем у чистой воды при всех температурах.Следовательно, кривая жидкость – пар для раствора пересекает горизонтальную линию, соответствующую P = 1 атм, при более высокой температуре, чем кривая для чистой воды.
Рисунок \ (\ PageIndex {1} \): фазовые диаграммы чистой воды и водного раствора нелетучих веществ. Кривая испарения раствора лежит ниже кривой чистой воды при всех температурах, что приводит к увеличению температуры кипения и снижению температуры замерзания раствора.Температура кипения раствора с нелетучим растворенным веществом всегда выше, чем точка кипения чистого растворителя.
Величина повышения температуры кипения связана с величиной снижения давления пара. Как мы только что обсудили, уменьшение давления пара пропорционально концентрации растворенного вещества в растворе. Следовательно, величина повышения температуры кипения также должна быть пропорциональна концентрации растворенного вещества (рисунок \ (\ PageIndex {2} \)). 0_b \) — температура кипения чистого растворителя.Мы можем выразить связь между \ (ΔT_b \) и концентрацией следующим образом
\ [ΔT_b = mK_b \ label {eq2} \]
, где m — концентрация растворенного вещества, выраженная в моляльности, а \ (K_b \) — константа повышения моляльной точки кипения растворителя, которая измеряется в ° C / м. В таблице \ (\ PageIndex {1} \) перечислены характерные значения в килобайтах для нескольких обычно используемых растворителей.
Рисунок \ (\ PageIndex {2} \): Снижение давления пара и повышение температуры кипения как функции мольной доли нелетучих растворенных веществДля относительно разбавленных растворов величина обоих свойств пропорциональна концентрации растворенного вещества.
| Растворитель | Точка кипения (° C) | К b (° C / м) | Температура замерзания (° C) | K f (° C / м) |
|---|---|---|---|---|
| уксусная кислота | 117.90 | 3,22 | 16,64 | 3,63 |
| бензол | 80,09 | 2,64 | 5,49 | 5,07 |
| d — (+) — камфора | 207,4 | 4,91 | 178,8 | 37,8 |
| сероуглерод | 46.2 | 2,42 | -112,1 | 3,74 |
| четыреххлористый углерод | 76,8 | 5,26 | −22,62 | 31,4 |
| хлороформ | 61,17 | 3,80 | −63,41 | 4,60 |
| нитробензол | 210.8 | 5,24 | 5,70 | 6,87 |
| вода | 100,00 | 0,51 | 0,00 | 1,86 |
Концентрация растворенного вещества обычно выражается как молярность, а не мольная доля или молярность по двум причинам. Во-первых, поскольку плотность раствора изменяется с температурой, значение молярности также зависит от температуры.Если точка кипения зависит от концентрации растворенного вещества, то по определению в системе не поддерживается постоянная температура. Во-вторых, моляльность и мольная доля пропорциональны для относительно разбавленных растворов, но моляльность имеет большее численное значение (мольная доля может быть только между нулем и единицей). Использование моляльности позволяет исключить незначащие нули.
Согласно таблице \ (\ PageIndex {1} \), постоянная молярного повышения точки кипения воды составляет 0,51 ° C / м. Таким образом, 1.00 м водный раствор нелетучего молекулярного растворенного вещества, такого как глюкоза или сахароза, будет иметь повышение температуры кипения на 0,51 ° C, что дает температуру кипения 100,51 ° C при 1,00 атм. Повышение температуры кипения 1,00 м водного раствора \ (\ ce {NaCl} \) будет примерно в два раза больше, чем у раствора глюкозы или сахарозы, потому что 1 моль \ (\ ce {NaCl} \) дает 2 моль растворенных ионов. Следовательно, раствор 1,00 м \ (\ ce {NaCl} \) будет иметь температуру кипения около 101,02 ° C.
Пример \ (\ PageIndex {3} \)
В примере \ (\ PageIndex {1} \) мы вычислили, что давление пара 30.2% -ный водный раствор этиленгликоля при 100 ° C на 85,1 мм рт. Ст. Меньше давления пара чистой воды. Мы заявили (без каких-либо доказательств), что это должно привести к более высокой температуре кипения раствора по сравнению с чистой водой. Теперь, когда мы увидели, почему это утверждение верно, вычислим температуру кипения водного раствора этиленгликоля.
Дано : состав раствора
Запрошенный : точка кипения
Стратегия :
Рассчитайте молярность этиленгликоля в 30.2% раствор. Затем используйте уравнение \ ref {eq2}, чтобы рассчитать повышение температуры кипения.
Решение :
Из Примера \ (\ PageIndex {1} \) мы знаем, что 30,2% раствор этиленгликоля в воде содержит 302 г этиленгликоля (4,87 моль) на 698 г воды. Таким образом, молярность раствора составляет
.\ [\ text {моляльность этиленгликоля} = \ left (\ dfrac {4.87 \; mol} {698 \; \ cancel {g} \; H_2O} \ right) \ left (\ dfrac {1000 \; \ cancel {g}} {1 \; кг} \ справа) = 6,98 м \]
По формуле \ ref {eq2}, повышение температуры кипения составляет
.\ [ΔT_b = mK_b = (6.98 \ cancel {m}) (0,51 ° C / \ cancel {m}) = 3,6 ° C \]
Таким образом, прогнозируется температура кипения раствора 104 ° C. Однако при концентрации растворенного вещества почти 7 м предположение о разбавленном растворе, используемом для получения уравнения \ ref {eq2}, может быть неверным.
Упражнение \ (\ PageIndex {3} \)
Предположим, что столовая ложка (5,00 г) \ (\ ce {NaCl} \) добавлена к 2,00 л воды при 20,0 ° C, которую затем доводят до кипения для приготовления спагетти. При какой температуре закипит вода?
Депрессия точки замерзания
Фазовая диаграмма на рисунке \ (\ PageIndex {1} \) показывает, что растворение нелетучих растворенных веществ в воде не только повышает температуру кипения воды, но и снижает ее температуру замерзания.Кривая твердое тело – жидкость для раствора пересекает линию, соответствующую P = 1 атм при более низкой температуре, чем кривая для чистой воды.
Это явление используется в схемах «антиобледенения», в которых используется соль (Рисунок \ (\ PageIndex {3} \)), хлорид кальция или мочевина для таяния льда на дорогах и тротуарах, а также при использовании этиленгликоля в качестве «Антифриз» в автомобильных радиаторах. Морская вода замерзает при более низкой температуре, чем пресная вода, поэтому Северный Ледовитый и Антарктический океаны остаются незамерзшими даже при температурах ниже 0 ° C (как и биологические жидкости рыб и других хладнокровных морских животных, обитающих в этих океанах).
Рисунок \ (\ PageIndex {3} \): Каменная соль (NaCl), хлорид кальция (CaCl 2 ) или их смесь используются для таяния льда. (кредит: модификация работы Эдди Велкера)Мы можем понять этот результат, представив, что у нас есть образец воды при нормальной температуре точки замерзания, где существует динамическое равновесие между твердым телом и жидкостью. Молекулы воды постоянно сталкиваются с поверхностью льда и переходят в твердую фазу с той же скоростью, с которой молекулы воды покидают поверхность льда и переходят в жидкую фазу.Если мы растворим в жидкости нелетучее растворенное вещество, такое как глюкоза, растворенные молекулы глюкозы уменьшат количество столкновений в единицу времени между молекулами воды и поверхностью льда, потому что некоторые из молекул, сталкивающихся со льдом, будут глюкозой. Однако у глюкозы совершенно другая структура, чем у воды, и она не может поместиться в решетку льда. Следовательно, присутствие молекул глюкозы в растворе может только уменьшить скорость, с которой молекулы воды в жидкости сталкиваются с поверхностью льда и затвердевают.Между тем скорость, с которой молекулы воды покидают поверхность льда и переходят в жидкую фазу, не меняется. В результате лед тает. Единственный способ восстановить динамическое равновесие между твердой и жидкой водой — снизить температуру системы, что снижает скорость, с которой молекулы воды покидают поверхность кристаллов льда, до тех пор, пока она не сравняется со скоростью, с которой молекулы воды в растворе сталкиваются. 0_f \) — точка замерзания чистого растворителя, а
Порядок членов обратный по сравнению с уравнением \ ref {eq1}, чтобы выразить депрессию точки замерзания как положительное число. Связь между \ (ΔT_f \) и концентрацией растворенного вещества задается уравнением, аналогичным уравнению \ ref {eq2}:
\ [ΔT_f = mK_f \ label {eq4} \]
где
- \ (м \) — моляльность раствора, а
- \ (K_f \) — молярная константа понижения температуры замерзания растворителя (в градусах ° C / м).
Как и \ (K_b \), каждый растворитель имеет характеристическое значение \ (K_f \) (Таблица \ (\ PageIndex {1} \)). Понижение точки замерзания зависит от общего количества растворенных нелетучих частиц растворенного вещества, как и при повышении точки кипения. Таким образом, водный раствор \ (\ ce {NaCl} \) имеет вдвое большую депрессию точки замерзания, чем раствор глюкозы той же молярности.
Люди, живущие в холодном климате, во многих отношениях используют понижение точки замерзания в своих интересах. Например, этиленгликоль добавляют в охлаждающую воду двигателя, чтобы предотвратить разрушение автомобильного двигателя, а метанол добавляют в жидкость для омывания ветрового стекла, чтобы предотвратить замерзание жидкости.Подогретые гликоли часто разбрызгиваются на поверхность самолетов перед взлетом в ненастную погоду зимой, чтобы удалить уже образовавшийся лед и предотвратить образование большего количества льда, что было бы особенно опасно, если бы оно образовалось на управляющих поверхностях самолета (видео \ (\ PageIndex {1} \)).
Видео \ (\ PageIndex {1} \): Понижение точки замерзания используется для удаления льда с поверхностей управления самолета.
Уменьшение давления пара, повышение температуры кипения и понижение точки замерзания раствора по сравнению с чистой жидкостью — все это зависит от общего количества растворенных нелетучих частиц растворенного вещества.
Пример \ (\ PageIndex {4} \)
В более холодных регионах США зимой на обледенелых дорогах часто поливают \ (\ ce {NaCl} \) или \ (\ ce {CaCl_2} \), чтобы растопить лед и сделать вождение более безопасным. Используйте данные на рисунке 13.9 для оценки концентраций двух насыщенных растворов при 0 ° C, одного из \ (\ ce {NaCl} \) и одного из \ (\ ce {CaCl_2} \), и вычислите точки замерзания обоих растворов, чтобы узнать, какая соль более эффективна для таяния льда.
Дано : растворимость двух соединений
Запрошено : концентрации и точки замерзания
Стратегия :
- Оцените растворимость каждой соли в 100 г воды из рисунка 13.9. Определите количество молей каждого в 100 г и рассчитайте моляльность.
- Определите концентрации растворенных солей в растворах. Подставьте эти значения в уравнение \ (\ PageIndex {4} \), чтобы вычислить понижения точки замерзания решений.
Решение :
A Из рисунка 13.9 мы можем оценить растворимость \ (\ ce {NaCl} \) и \ (\ ce {CaCl_2} \) как примерно 36 г и 60 г соответственно на 100 г воды при 0 ° С.Соответствующие концентрации по моляльности составляют
\ [m _ {\ ce {NaCl}} = \ left (\ dfrac {36 \; \ cancel {g \; NaCl}} {100 \; \ cancel {g} \; H_2O} \ right) \ left (\ dfrac {1 \; mol \; NaCl} {58.44 \; \ cancel {g \; NaCl}} \ right) \ left (\ dfrac {1000 \; \ cancel {g}} {1 \; kg} \ right) = 6,2 \; м \]
\ [m _ {\ ce {CaCl_2}} = \ left (\ dfrac {60 \; \ cancel {g \; CaCl_2}} {100 \; \ cancel {g} \; H_2O} \ right) \ left (\ dfrac {1 \; mol \; CaCl_2} {110.98 \; \ cancel {g \; CaCl_2}} \ right) \ left (\ dfrac {1000 \; \ cancel {g}} {1 кг} \ right) = 5,4 \; м \]
Более низкая формульная масса \ (\ ce {NaCl} \) более чем компенсирует его более низкую растворимость, что приводит к получению насыщенного раствора с немного большей концентрацией, чем \ (\ ce {CaCl_2} \).
B Поскольку эти соли являются ионными соединениями, которые диссоциируют в воде с образованием двух и трех ионов на формульную единицу \ (\ ce {NaCl} \) и \ (\ ce {CaCl_2} \), соответственно, фактические концентрации растворенных частицы в двух насыщенных растворах составляют 2 × 6,2 м = 12 м для \ (\ ce {NaCl} \) и 3 × 5,4 м = 16 м для \ (\ ce {CaCl_2} \). Результирующие понижения точки замерзания можно рассчитать с помощью уравнения \ (\ PageIndex {4} \):
\ [\ ce {NaCl}: ΔT_f = mK_f = (12 \; \ cancel {m}) (1.86 ° C / \ cancel {m}) = 22 ° C \]
\ [\ ce {CaCl2}: ΔT_f = mK_f = (16 \; \ cancel {m}) (1.86 ° C / \ cancel {m}) = 30 ° C \]
Поскольку точка замерзания чистой воды составляет 0 ° C, фактические точки замерзания растворов составляют –22 ° C и –30 ° C соответственно. Обратите внимание, что \ (\ ce {CaCl_2} \) значительно более эффективен при понижении температуры замерзания воды, поскольку его растворы содержат три иона на формульную единицу. Фактически, \ (\ ce {CaCl_2} \) — соль, обычно продаваемая для домашнего использования, а также ее часто используют на автомагистралях.
Поскольку растворимость обеих солей уменьшается с понижением температуры, точка замерзания может быть понижена только на определенную величину, независимо от того, сколько соли разбросано по обледенелой дороге.Если температура значительно ниже минимальной температуры, при которой одна из этих солей вызывает таяние льда (скажем, −35 ° C), нет смысла использовать соль, пока она не станет теплее
Упражнение \ (\ PageIndex {4} \)
Рассчитайте точку замерзания 30,2% раствора этиленгликоля в воде, давление пара и точку кипения которой мы рассчитали в Примере \ (\ PageIndex {6} \). 8 и Примере \ (\ PageIndex {6} \). 10.
- Ответ
−13.0 ° С
Пример \ (\ PageIndex {5} \)
Расположите эти водные растворы в порядке уменьшения точки замерзания: 0,1 м \ (KCl \), 0,1 м глюкозы, 0,1 м SrCl2, 0,1 м этиленгликоля, 0,1 м бензойной кислоты и 0,1 м HCl.
Дано : молярности шести растворов
Запрошено: точки относительного замерзания
Стратегия :
- Определите каждое растворенное вещество как сильное, слабое или неэлектролитное и используйте эту информацию для определения количества образовавшихся частиц растворенного вещества.
- Умножьте это число на концентрацию раствора, чтобы получить эффективную концентрацию растворенных частиц. Раствор с наивысшей эффективной концентрацией частиц растворенного вещества имеет наибольшее понижение точки замерзания.
Решение :
A Поскольку молярные концентрации всех шести растворов одинаковы, мы должны сосредоточиться на том, какие из веществ являются сильными электролитами, какие — слабыми электролитами, а какие неэлектролитами, чтобы определить фактическое количество частиц в растворе.\ (KCl \), \ (SrCl_2 \) и \ (HCl \) — это сильных электролита , производящих два, три и два иона на формульную единицу соответственно. Бензойная кислота — слабый электролит (примерно одна частица на молекулу), а глюкоза и этиленгликоль — оба неэлектролиты (одна частица на молекулу).
B Моляльность растворов по отношению к общему количеству частиц растворенного вещества составляет: \ (KCl \) и \ (HCl \), 0,2 мкм; \ (SrCl_2 \), 0,3 м; глюкоза и этиленгликоль — 0,1 м; и бензойная кислота, 0.1–0,2 м. Поскольку величина снижения температуры замерзания пропорциональна концентрации растворенных частиц, порядок точек замерзания растворов следующий: глюкоза и этиленгликоль (самая высокая точка замерзания, минимальное снижение точки замерзания)> бензойная кислота> \ (HCl \ ) = \ (KCl \)> \ (SrCl_2 \).
Упражнение \ (\ PageIndex {5} \)
Расположите эти водные растворы в порядке увеличения температуры замерзания: 0,2 м \ (NaCl \), 0,3 м уксусной кислоты, 0,1 м \ (\ ce {CaCl_2} \) и 0.2 м сахарозы.
- Ответ
0,2 м \ (\ ce {NaCl} \) (самая низкая точка замерзания) <0,3 м уксусная кислота ≈ 0,1 м \ (\ ce {CaCl_2} \) <0,2 м сахароза (самая высокая точка замерзания)
Определение молярных масс
Осмотическое давление и изменения точки замерзания, точки кипения и давления пара прямо пропорциональны концентрации присутствующего растворенного вещества. Следовательно, мы можем использовать измерение одного из этих свойств для определения молярной массы растворенного вещества по результатам измерений.
Определение молярной массы по депрессии точки замерзания
Обнаружено, что раствор 4,00 г неэлектролита в 55,0 г бензола замерзает при 2,32 ° C. Какова молярная масса этого соединения?
Решение
Мы можем решить эту проблему, выполнив следующие действия.
- Определите изменение точки замерзания от наблюдаемой точки замерзания и точки замерзания чистого бензола (Таблица \ (\ PageIndex {1} \)).{−1}} = 0,63 \: м \)
- Определите количество молей соединения в растворе по молярной концентрации и массе растворителя, использованного для приготовления раствора.
\ (\ mathrm {Moles \: of \: solute = \ dfrac {0,62 \: mol \: solute} {1,00 \ cancel {кг \: растворитель}} × 0,0550 \ cancel {кг \: растворитель} = 0,035 \: моль} \)
- Определите молярную массу из массы растворенного вещества и числа молей в этой массе.
\ (\ mathrm {Молярная \: масса = \ dfrac {4.2 \: г / моль} \)
- Ответ
1,8 × 10 2 г / моль
- Повышение точки кипения : \ [ΔT_b = mK_b \]
- Депрессия точки замерзания: \ [ΔT_f = mK_f \]
- понижение точки замерзания охлаждающей жидкости
- повышение температуры кипения охлаждающей жидкости
- 50:50 (-30 ° F)
- 30:70 (5 ° F)
- 70:30 (-60 ° F)
Упражнение \ (\ PageIndex {6} \)
Раствор 35,7 г неэлектролита в 220,0 г хлороформа имеет температуру кипения 64,5 ° C. Какова молярная масса этого соединения?
Определение молярной массы по осмотическому давлению
Образец водного раствора объемом 0,500 л, содержащий 10,0 г гемоглобина, имеет осмотическое давление 5.0_B \]
Коллигативные свойства раствора зависят только от общего количества растворенных частиц в растворе, а не от их химической идентичности. Коллигативные свойства включают давление пара, точку кипения, точку замерзания и осмотическое давление. Добавление нелетучего растворенного вещества (без измеряемого давления пара) снижает давление пара растворителя.Давление паров раствора пропорционально мольной доле растворителя в растворе, это соотношение известно как закон Рауля . Решения, подчиняющиеся закону Рауля, называются идеальными решениями. Большинство реальных решений демонстрируют положительные или отрицательные отклонения от закона Рауля. Повышение точки кипения (\ (ΔT_b \)) и понижение точки замерзания (\ (ΔT_f \)) раствора определяются как разница между точками кипения и замерзания, соответственно, раствора и чистого растворителя.Оба они пропорциональны моляльности растворенного вещества.
Что такого ужасного в пропиленгликоле?
Элли спрашивает… В последнее время я встречал слова «без пропиленгликоля» на многих продуктах вместе с «без парабенов» и «без минеральных масел». Погуглил, чтобы узнать, что в нем такого вредного, и здесь обнаружил, что паспорт безопасности материала предупреждает пользователей, чтобы они избегали контакта кожи с пропиленгликолем, так как этот сильный раздражитель кожи может вызвать аномалии печени и почек ».Был бы очень признателен, если бы кто-нибудь мог пролить свет на эту проблему.
The Beauty Brains отвечает:
Пропиленгликоль (или PG, как мы его называем косметологами) в основном используется в косметических продуктах для улучшения стабилизации эмульсий при замораживании-оттаивании. Несколько процентов или меньше PG могут предотвратить развитие зернистой, творожной текстуры крема или лосьона при воздействии низких температур. Он также имеет увлажняющие свойства, аналогичные глицерину (который используется чаще.)
Но PG, наряду со многими другими химическими веществами, получил плохую репутацию от таких групп, как EWG. Например, согласно веб-сайту The Good Human, основная роль PG — «помочь любым другим химическим веществам, с которыми вы вступаете в контакт, попасть в ваш кровоток». и что он «изменяет структуру кожи, позволяя химическим веществам проникать глубоко под нее, увеличивая их способность достигать кровотока.
Звучит довольно плохо, не правда ли? Но давайте посмотрим, что на самом деле говорит наука о пропиленгликоле в косметике.
Почему пропиленгликоль используется в косметике?
Как я уже отмечал выше, основной причиной использования PG в косметике является улучшение текстуры продукта. Для достижения этого эффекта требуются относительно небольшие количества, порядка 2% или меньше. Чтобы быть справедливым, я должен также указать, что PG используется в более высоких концентрациях в некоторых продуктах, где он действует как растворитель для других ингредиентов. Но он НЕ используется в первую очередь для того, чтобы помочь другим ингредиентам проникнуть в кровоток.
Опасен ли пропиленгликоль в косметике?
По данным Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, пропиленгликоль признан безопасным (GRAS) для непосредственного добавления в пищу.Он также разрешен к использованию в качестве пеногасителя в пищевых добавках непрямого действия. Комиссия по рассмотрению косметических ингредиентов (группа ученых, изучающих безопасность косметических ингредиентов) определила, что он «безопасен для использования в косметических продуктах, если не вызывает раздражения». По сути, это означает, что компаниям необходимо проводить испытания новых формул на раздражение кожи, чтобы убедиться, что PG не вызывает раздражения при смешивании с другими ингредиентами. Это стандартный тест, который компании проводят для новых продуктов, поэтому в нем нет ничего страшного.(Кстати, тестирование проводится на людях, а не на животных.) Кроме того, многие пероральные и внутривенные препараты содержат значительные количества PG. Я считаю, что если ингредиент безопасен для проглатывания И безопасен для использования в инъекционных наркотиках, он вряд ли вызовет какие-либо проблемы в косметике для местного применения.
А как насчет проникновения через кожу?
Позвольте мне пояснить: пропиленгликоль является одним из ингредиентов, проникающих через кожу, но «абсорбция через кожу минимальна». Поскольку PG сам по себе безопасен для проглатывания (он либо выводится с мочой, либо распадается в крови с образованием молочной кислоты, которая естественным образом вырабатывается вашим организмом, токсичность на самом деле не проблема.Единственные случаи, когда PG попадание в кровоток вызывало проблемы, возникали при нанесении кремов, содержащих PG, на большие участки обожженной кожи. Это имеет смысл, поскольку на обгоревшей коже не будет внешнего защитного слоя. В этих случаях наблюдались легкий лактоацидоз и гиперосмоляльность сыворотки. Конечно, нет проблем, когда низкие уровни PG наносятся на здоровую, неповрежденную кожу.
Сколько стоит PG?
Согласно отчету Всемирной организации здравоохранения, расчетная допустимая суточная доза PG составляет около 25 мг пропиленгликоля на кг массы тела.(Семидесятый отчет Комитета экспертов ФАО / ВОЗ, 1974 г.). Для человека весом 130 фунтов это будет около 0,11 унции PG в день, прежде чем у вас могут возникнуть проблемы. То есть, проглотив его, вы сможете нанести НАМНОГО больше на кожу, поскольку лишь небольшое количество действительно проникает через кожу в кровоток.
А как насчет улучшения проникновения?
Итак, PG безопасен сам по себе, но как насчет того, чтобы помочь другим ингредиентам проникнуть через кожу? Это единственный вопрос, на который я не мог получить четкого ответа.Я не смог найти никаких исследований, показывающих, какие ингредиенты PG увеличивают проникновение и насколько. Однако, учитывая, что он используется в относительно высоких количествах в лекарственных препаратах местного действия, мне кажется маловероятным, что он вызовет проблемы при более низких уровнях, используемых в большинстве косметических средств.
Итоги Beauty Brains
Всегда хорошо знать о химических веществах, которые вы вводите или наносите на свой организм. Но, судя по последним научным данным, не стоит особо беспокоиться о косметике, содержащей пропиленгликоль.
Что такое антифриз? — кривошипно-сдвиг
Антифриз — это присадка, которая может изменять точки замерзания и кипения охлаждающей жидкости в двигателях внутреннего сгорания, использующих водяное охлаждение. Как следует из названия, основное назначение этих присадок — предотвратить замерзание охлаждающей жидкости, что может вызвать серьезное повреждение двигателя. Однако современные антифризы также позволяют системам охлаждения работать более эффективно за счет повышения температуры кипения раствора охлаждающей жидкости.В прошлом в качестве антифриза использовались различные вещества, но в большинстве современных автомобильных применений используется этиленгликоль.
Этиленгликоль — самый распространенный вид автомобильных антифризов. Естественно бесцветный, он обычно окрашен в ярко-зеленый цвет.
История антифриза
История антифризов уходит корнями в ранние дни автомобилестроения. Первым автомобильным антифризом был метиловый спирт или метанол, температура замерзания которого ниже, чем у воды.Это сделало его хорошим антифризом, но другие характеристики метанола сделали его плохим автомобильным антифризом.
В частности, спирт имеет тенденцию разъедать металлы, с которыми он контактирует внутри систем охлаждения. Он также испарялся при нормальном использовании из-за того, что ранние радиаторы не были герметичными, поскольку ранние системы водяного охлаждения не находились под давлением.
После метилового спирта, этиленгликоль был следующим популярным антифризом. Это химическое вещество было впервые синтезировано в середине 19 века, но оно не использовалось в качестве антифриза до второго десятилетия 20 века.В то время он продавался как «постоянный» антифриз из-за того, что он не испарялся, как спирт.
К концу Второй мировой войны, во время которой он широко использовался для охлаждения военной техники, этиленгликоль был преобладающим типом автомобильного антифриза. Этиленгликоль и системы охлаждения под давлением были настолько эффективны, что двигатели с воздушным охлаждением практически не использовались в автомобильной промышленности.
В новейшей истории был сделан ряд разработок в области антифризов.Пропиленгликоль в настоящее время используется в некоторых приложениях из-за немного меньшей токсичности, а некоторые смеси антифризов также содержат химические вещества, полученные на основе органических кислот (ОАТ).
См. Также: История антифриза
Как работает антифриз?
Антифриз выполняет две основные функции:
Основная задача антифриза — снизить точку замерзания охлаждающей жидкости, что важно из-за того, как вода расширяется при замерзании.Поскольку системы охлаждения закрыты, замерзшая охлаждающая жидкость будет иметь тенденцию расширяться и вызывать катастрофический отказ двигателя из-за деформации или растрескивания каналов охлаждающей жидкости в блоке цилиндров и головке.
Вода расширяется при замерзании, что может создать большие проблемы для системы охлаждения.
Антифриз не только снижает температуру замерзания воды, но и повышает ее температуру кипения. Поскольку точка кипения на также повышается на из-за давления в системе охлаждения, это позволяет двигателям работать более горячими без перегрева.
Спирт как антифриз
В автомобилях метанол — это тип спирта, который использовался в качестве антифриза. Спирт в целом и метанол в частности — отличный антифриз, и он до сих пор используется в некоторых растворах для омывателей ветрового стекла и других применениях. Тем не менее, он имеет тенденцию вызывать коррозию при контакте с металлом внутри систем охлаждения. Он особенно агрессивен по отношению к алюминию, что является проблемой из-за широкого использования алюминия в производстве головок цилиндров (и, в меньшей степени, блоков).)
В некоторых жидкостях для омывателей ветрового стекла в качестве антифриза используется спирт.
Этиленгликоль
Хотя этиленгликоль впервые получил широкое распространение при производстве взрывчатых веществ и до сих пор широко используется в различных промышленных применениях, он является наиболее распространенным типом автомобильных антифризов. Он имеет температуру замерзания 9 ° F (-12,9 ° C) и точку кипения 387 ° F (197,3 ° C), что делает его отличным антифризом. Он также смешивается с водой, что означает, что его можно смешивать практически в любой пропорции для создания охлаждающей жидкости двигателя.
Одна проблема с этиленгликолем заключается в том, что он не может выдерживать такую большую тепловую нагрузку, как чистая вода. Фактически, чистый этиленгликоль имеет примерно половину удельной теплоемкости, чем прямая вода. По сути, это означает, что вода в два раза эффективнее отводит тепло от двигателя. Однако смешивание воды и этиленгликоля вместе эффективно изменяет точки замерзания и кипения, не теряя слишком много в области теплопередачи.
Этиленгликоль обеспечивает хорошее сочетание низкой точки замерзания и приемлемых характеристик теплопередачи при смешивании с водой.
Хотя чистый этиленгликоль замерзает при 9 ° F, а вода — при 32 ° F, их смешивание фактически снижает температуру замерзания еще больше. Это связано с тем, что этиленгликоль предотвращает водородные связи в воде, а вода препятствует кристаллизации этиленгликоля.
Соотношение этиленгликоля и воды в смеси
Поскольку этиленгликоль смешивается с водой, можно использовать различные соотношения для достижения желаемых характеристик охлаждающей жидкости. Некоторые общие отношения этиленгликоля к воде включают:
Токсичность антифриза
Токсичность антифриза вызывает опасения из-за широкого использования этиленгликоля.Хотя он не очень токсичен, потребление достаточного количества этиленгликоля может быть смертельным. Это особенно опасно для домашних животных и маленьких детей из-за их малой массы тела и того факта, что антифриз может иметь сладкий вкус. Чтобы бороться с этим, к антифризу часто примешивают горький агент. В некоторых юрисдикциях это фактически требуется по закону.
Пропиленгликоль
Пропиленгликоль несколько менее токсичен, чем этиленгликоль, и он используется во многих отраслях промышленности, где токсичность является проблемой.Фактически, его можно использовать в качестве добавки к таким продуктам питания, как мороженое и выпечка. Его можно назвать «нетоксичным», но он все же опасен в достаточно больших количествах.
Глицерин
Другой нетоксичной альтернативой антифризу является глицерин, который недолго использовался в автомобилях до широкого распространения этиленгликоля. Он работает по тому же методу, что и полипропиленгликоль, предотвращая образование водородных связей, но его производство было слишком дорогим. Это может измениться в будущем, и недавние исследования показывают, что это может быть жизнеспособной альтернативой этиленгликолю.
Проверка антифриза
Антифриз необходимо регулярно проверять, чтобы убедиться, что он остается в хорошем состоянии. Со временем он ухудшается, и это может привести к тому, что старый антифриз не сможет обеспечить достаточную защиту от замерзания. Это также может привести к другим проблемам с системой охлаждения, поскольку грязный антифриз часто приводит к коррозии металлических компонентов и эрозии прокладок.
Перед проверкой антифриза необходимо убедиться, что двигатель холодный. Если снять крышку радиатора с горячей системы под давлением, вы можете получить серьезные ожоги.Если вы не уверены, лучше перестраховаться и подождать.
Регулярная проверка антифриза предотвратит накопление шлама и последующее повреждение двигателя.
Самый простой способ проверить антифриз — это ареометр, который измеряет удельный вес охлаждающей смеси. Эти устройства вытягивают небольшое количество антифриза, а затем вы читаете индикатор на поплавке, чтобы определить защиту раствора от замерзания. Если защита от замерзания низкая, можно слить охлаждающую жидкость и добавить антифриз.Если охлаждающая жидкость выглядит грязной, ее следует промыть.
Помимо простого наблюдения за изменением цвета антифриза, вы также можете использовать полоску pH для проверки состояния антифриза. Охлаждающая жидкость обычно должна иметь слегка щелочной pH (около 9,5 — 10), хотя вы можете уточнить у производителя, какой именно pH он рекомендует.
Категория: ароматизаторы США / ЕС / FDA / JECFA / FEMA / FLAVIS / Ученый / Патентная информация:
Физические свойства:
Органолептические свойства:
Косметическая информация: Поставщиков:
Информация по безопасности:
Информация о безопасности использования:
Ссылки по безопасности:
Артикул: Другая информация: Примечание о потенциальных блендерах и основных компонентахВозможное использование: Возникновение (природа, еда, прочее): примечаниеСинонимов:
Статей: | |||
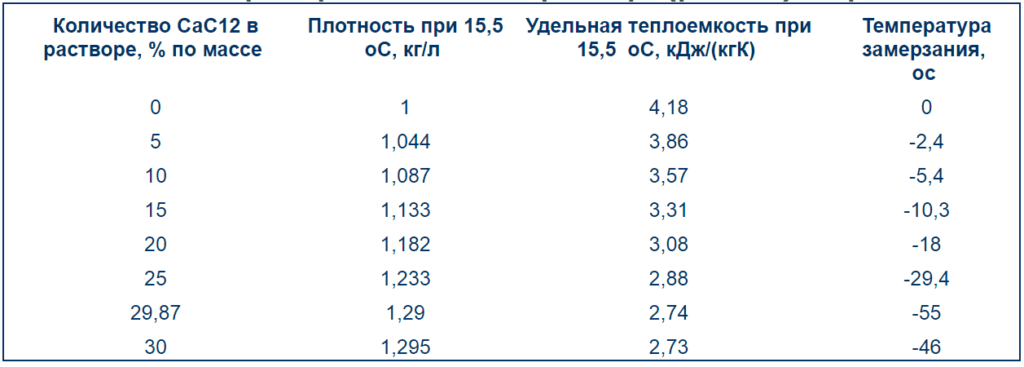
 Основные требования к антифризам: низкая температура замерзания, высокие теплоемкость и теплопроводность, небольшая вязкость при низких температурах, малая вспениваемость, высокие температуры кипения и воспламенения. Кроме того, антифризы не должны вызывать разрушения конструкционных материалов, из которых изготовлены детали систем охлаждения.
Основные требования к антифризам: низкая температура замерзания, высокие теплоемкость и теплопроводность, небольшая вязкость при низких температурах, малая вспениваемость, высокие температуры кипения и воспламенения. Кроме того, антифризы не должны вызывать разрушения конструкционных материалов, из которых изготовлены детали систем охлаждения. При растворении этиленгликоля в воде выделяется теплота и происходит уменьшение объема. Водные растворы замерзают при низких температурах. Этиленгликоль токсичен при попадании внутрь, действует на центральную нервную систему и почки; смертельная доза 1,4 г/кг. ПДК в воздухе рабочей зоны 5 мг/м
При растворении этиленгликоля в воде выделяется теплота и происходит уменьшение объема. Водные растворы замерзают при низких температурах. Этиленгликоль токсичен при попадании внутрь, действует на центральную нервную систему и почки; смертельная доза 1,4 г/кг. ПДК в воздухе рабочей зоны 5 мг/м


 Плотность, температура замерзания, теплоемкость Cp, теплопроводность, водного раствора пропиленгликоля = 1,2 пропандиол =1,2-Propylenglycol- антифриза и теплоносителя для систем отпления и центрального кондиционирования.
Плотность, температура замерзания, теплоемкость Cp, теплопроводность, водного раствора пропиленгликоля = 1,2 пропандиол =1,2-Propylenglycol- антифриза и теплоносителя для систем отпления и центрального кондиционирования.
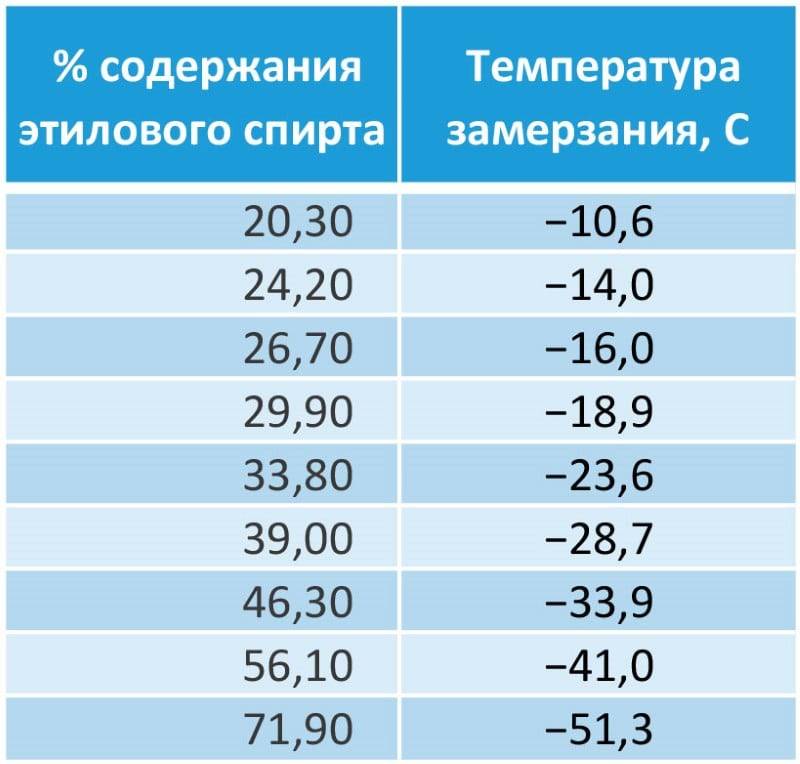
 Температура замерзания водных растворов этиленгликоля и пропиленгликоля. Концентрация по массе.
Температура замерзания водных растворов этиленгликоля и пропиленгликоля. Концентрация по массе.
 куб.
куб. 8 Дж / (кг · К) = 1 ккал / (кг o C)
8 Дж / (кг · К) = 1 ккал / (кг o C)